Сурьма окисьТрехокись сурьмы Sb2O3 получают прокаливанием окислов сурьмы пли сурьмяных солей летучих кислот при температуре выше 920° С. Однако при охлаждении на воздухе может вновь
произойти окисление с образованием четырехокиси сурьмы.
Чтобы очистить продукт, его следует возогнать в вакууме при 930° С. Давление паров трехокиси сурьмы при 812° С равно 40 мм рт. ст.. при 950е С — 100 мм рт. ст.
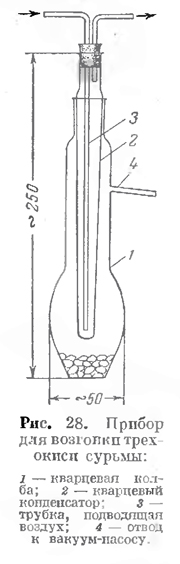
Для возгонки можно воспользоваться кварцевым прибором (рис. 28), состоящим из колбы 1 с боковым отводом 4 для присоединения к вакуум-насосу и конденсатора 2, па котором
осаждается трехокись. Охлаждается конденсатор током воздуха, поступающим через кварцевую пли фарфоровую трубку 3 от воздуходувки или от нагнетающего водоструйного насоса.
Четырехокнсь сурьмы Sb2O4 получают прокаливанием пятиокиси при температуре не выше 920° С. Выше этой температуры происходит дальнейшее постепенное отщепление кислорода
и продукт загрязняется трехокисью.
Пятиокись сурьмы Sb2O5 получают путем обезвоживания гидратированной пятиокиси сурьмы.
Гидрат можно легко получить или путем растворения металлической сурьмы в азотной кислоте с последующим выпариванием кислоты, или гидролизом пентахлорида сурьмы.
Прокаливание гидрата пятиокиси сурьмы следует проводить при температуре около 270 С. Выше этой температуры происходит постепенное отщепление кислорода, и продукт
загрязняется четырехокисью сурьмы. При прокаливании ниже 270° С процесс дегидратации может не дойти до конца.
Все окислы сурьмы светло-желтого цвета; при комнатной температуре па воздухе устойчивы.
|

